- Son moleculas producidas por las celulas de los organismos vivos con la funcion especifica de catalizar reacciones quimicas.
¿COMO SE CLASIFICAN LAS ENZIMAS?
Oxidorreductasas: catalizan reacciones de oxidacion y reduccion. Emplean Co enzimas NAD+, NADP+ y FAD.
- Transferasas: realizan muchos pasos importantes del metabolismo requieren transferasas de 1 molecula a otra, de grupos amino, carboxilo, carbonilo, metilo, acido, glucosilo o fosforilo. Utilizan tetrahidrofolato y fosfato piridoxal.
Hidrolasas: catalizan el rompimiento de una molecula con participacion de agua, entre enlaces de carbono y otro atomo. - Liasas: catalizan el rompimiento no hidrolitico entre carbono y carbono, carbono y azufre y algunos carbono e hidrogeno. Pertenecen las descarboxilasas.
- Isomerasas: incluye todas las enzimas que catalizan la interconversion de todo tipo de isomeros opticos, de posicion y reacciones de oxido rreduccion intramolecular.Pertenecen rasemasas, epimerasas y mutasas.
Ligasas: catalizan la formacion de enlaces entre carbono y oxigeno, nitrodeno y otros atomos a expensas de un enlace fosfato de alta energia de ATP.Pertenecen acetil CoA sintetasa.
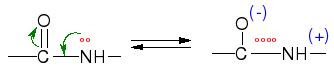
¿COMO ACTUAN LAS ENZIMAS?
- Si en la reaccion se absorve calor, los productos tendran mas energia que los reactantes; los cambios de energia libre y de entalpia son positivos y es una reaccion endergonica. Si la reaccion que desprende calor son negativas entonces es exotermica.
- La enzima es afectada por una serie de factores externos e internos pueden ser fisicos, quimicos y biologicos, temperatura, pH, fuerza ionica, concentracion de sustrato de la enzima, del producto e inhibidores.
- Las enzimas son generalmente proteínas globulares que pueden presentar tamaños muy variables, desde 62 aminoácidos como en el caso del monómero de la 4-oxalocrotonato tautomerasa,hasta los 2500 presentes en la sintasa de ácidos grasos.
Las actividades de las enzimas vienen determinadas por su estructura tridimensional. Casi todas las enzimas son mucho más grandes que los sustratos donde actúan, y solo una pequeña parte de la enzima (alrededor de 3 a 4 aminoácidos) están directamente involucrados en la catálisis. La región que contiene estos residuos encargados de catalizar la reacción es conocida como centro activo. Las enzimas también pueden contener sitios con la capacidad de unir cofactores, necesarios a veces en el proceso de catálisis, o de unir pequeñas moléculas, como los sustratos o productos (directos o indirectos) de la reacción catalizada. Estas uniones pueden incrementar o disminuir la actividad enzimática, dando lugar así una regulación por retroalimentación.
Al igual que las demás proteínas, las enzimas se componen de una cadena lineal de aminoácidos que se pliegan durante el proceso de traducción para dar lugar a una estructura terciaria tridimensional de la enzima, susceptible de presentar actividad. Cada secuencia de aminoácidos es única y por tanto da lugar a una estructura única, con propiedades únicas. En ocasiones, proteínas individuales pueden unirse a otras proteínas para formar complejos, en lo que se denomina estructura cuaternaria de las proteínas.
La mayoría de las enzimas, al igual que el resto de proteínas, pueden ser desnaturalizadas si se ven sometidas a agentes desnaturalizantes como el calor, los pHs extremos o ciertos compuestos como el SDS. Estos agentes destruyen la estructura terciaria de las proteínas de forma reversible o irreversible, dependiendo de la enzima.
¿QUE ES UNA APOENZIMA?
- Es la parte proteica de una enzima, desprovista de los cofactores o coenzimas que puedan ser necesarios para que la enzima sea funcionalmente activa. La apoenzima es catalíticamente inactiva; cuando se le une la coenzima o cofactor adecuados, constituye la holoenzima.
¿QUE ES UNA COENZIMA?
- Los coenzimas son cofactores orgánicos no proteicos, termoestables, que unidos a una apoenzima constituyen la holoenzima o forma catalíticamente activa de la enzima. Tienen en general baja masa molecular (al menos comparada con la apoenzima) y son claves en el mecanismo de catálisis, por ejemplo, aceptando o donando electrones o grupos funcionales, que transportan de un enzima a otro.
A diferencia de las enzimas, los coenzimas se modifican y consumen durante la reacción química; por ejemplo, el NAD+ se reduce a NADH cuando acepta dos electrones (y un protón) y por tanto se agota; cuando el NADH libera sus electrones se recupera el NAD+, que de nuevo puede actuar como coenzima.
- La cinética enzimática estudia la velocidad de las reacciones químicas que son catalizadas por las enzimas. El estudio de la cinética de una enzima permite explicar los detalles de su mecanismo catalítico, su papel en el metabolismo, cómo es controlada su actividad en la célula y cómo puede ser inhibida su actividad por fármacos o venenos o potenciada por otro tipo de moléculas.

CHECA ESTA PAGINA PARA UNA MEJOR COMPRENSION DE LAS ENZIMAS: